Материали за лекция 5





Лекция 5
АРОМАТНИ ВЪГЛЕВОДОРОДИ
КЛЮЧОВИ ДУМИ: ароматни въглеводороди, арени, sp2-хибридизация, единичен p-електронен облак, кръгова конюгация, механизъм на реакция на йонно заместване, електрофилно заместване, нитриране, халогениране, алкилиране по Фридел-Крафтс, алкилиране с алкени, хидрогениране, окисляване.
СТРУКТУРА НА МОЛЕКУЛАТА БЕНЗОЛ. АРОМАТНОСТ
Ароматните въглеводороди (арени) са въглеводороди, чиито молекули съдържат един или повече бензенови пръстени.
Най-простият представител на ароматните въглеводороди е бензенът, чиято молекулна формула е C 6 H 6. Установено е, че всички въглеродни атоми в молекулата на бензена лежат в една и съща равнина, образувайки правилен шестоъгълник (фиг. 1). Всеки въглероден атом е свързан с един водороден атом. Дължините на всички въглерод-въглеродни връзки са еднакви и възлизат на 0,139 nm.
Формули а) и б) са предложени през 1865 г. от немския химик Август Кекуле. Въпреки факта, че те не предават точно структурата на молекулата на бензена, те все още се използват днес и се наричат формули на Кекуле.
Исторически името "ароматни въглеводороди" се появи, защото много производни на бензен, които бяха първите изолирани от естествени източници, имаха приятна миризма.
Понастоящем понятието „ароматност“ означава, на първо място, специалния характер на реактивността на веществата, което от своя страна се определя от структурните характеристики на молекулите на тези съединения.
Какви са тези функции?
В съответствие с молекулната формула C 6 H 6 бензенът е ненаситено съединение и може да се очаква, че ще претърпи реакции на присъединяване, типични за алкените. Въпреки това, при условия, при които алкените преминават бързо в реакции на присъединяване, бензенът не реагира или реагира бавно. Бензолне дава характерни качествени реакции, характерни за ненаситените въглеводороди: то не обезцветява бромна вода и воден разтвор на калиев перманганат.
Този характер на реактивност се обяснява с наличието на конюгирана система в ароматния пръстен - единичен стр- електронен облак.
В молекулата на бензена всеки въглероден атом е в състояние sp 2-хибридизация и е свързан с три с-връзки с два въглеродни атома и един водороден атом. Четвъртият валентен електрон на въглеродния атом е разположен на стр-орбитала, перпендикулярна на равнината на молекулата. В молекулата на бензена възниква странично припокриване Р-орбитали на всеки въглероден атом с Р-орбитали на двата съседни въглеродни атома (фиг. 2). В резултат на това свързване, a единичен p-електронен облак, разположен над и под равнината на бензеновия пръстен - се извършва кръгова половинка.
Такава циклична система с общ облак от шест електрона е много стабилна и енергийно изгодна; Следователно бензенът за предпочитане влиза в онези реакции, при които ароматният пръстен се запазва.
 А А |  b b |
Ориз. 2. Електронна структура на молекулата на бензена: а) схема на припокриване Р-орбитали; б) единичен р-електронен облак.
Нека подчертаем още веднъж, че в молекулата на бензена е невъзможно да се разграничат три двойни и три единични връзки. Електронната плътност е разпределена равномерно в молекулата и всички връзки между въглеродните атоми са абсолютно еднакви. Следователно трябва да помним, че формулата на Кекуле, която често се използва за изобразяване на бензен, е произволна и не отразява реалната структура на неговата молекула.
И така, ароматните съединения са тези, чиито молекули съдържат стабилна циклична група със специален характер на връзката. Имайки молекулна формула, показваща висока степен на ненаситеност, тези вещества обаче не реагират като ненаситени, а влизат предимно в реакции на заместване, като запазват ароматната система.
ХОМОЛОЗИ НА БЕНЗЕЛ,
ИЗОМЕРИЯ, НОМЕНКЛАТУРА
Общата формула на хомоложната серия от ароматни въглеводороди е C n H 2 n -2.
Най-близкият хомолог на бензена е метилбензенът. По-често те използват тривиалното му име - толуен:

Бензолът и толуенът нямат ароматни изомери. Тези вещества се характеризират само междукласова изомерия. Така неконвертируемите нециклични въглеводороди, съдържащи две тройни или две двойни и една тройна връзка в молекулата, съответстват на молекулната формула C 6 H 6 и следователно са изомерни на бензена, например:
![]()
![]()
Започвайки с арени с осем въглеродни атома, възниква възможността за изомерия поради състав и относително разположение на въглеводородните радикали.Ако два заместителя са свързани към бензеновия пръстен, тогава те могат да бъдат в три различни позиции един спрямо друг: един до друг (тази позиция се обозначава с префикса орто-), през един въглероден атом ( мета-), и един срещу друг ( чифт-). Диметилбензенът, чиито изомери са дадени по-долу, има тривиално име ксилен
По този начин молекулната формула C 8 H 8 съответства на четири изомерни ароматни въглеводороди:



Физични свойства
Бензолът и неговите най-близки хомолози са безцветни течности със специфична миризма. Ароматните въглеводороди са по-леки от водата и не се разтварят в нея, но са лесно разтворими в органични разтворители - алкохол, етер, ацетон.
Бензолът и неговите хомолози сами по себе си са добри разтворители за много органични вещества. Всички арени горят с димящ пламък поради високото съдържание на въглерод в техните молекули.
Физическите свойства на някои арени са представени в таблицата.
Таблица. Физически свойства на някои арени
|
Име |
Формула |
t°.pl., |
t°.b.p., |
|
Бензол |
C6H6 |
5,5 |
80,1 |
|
Толуен (метилбензен) |
C 6 H 5 CH 3 |
95,0 |
110,6 |
|
Етилбензен |
C 6 H 5 C 2 H 5 |
95,0 |
136,2 |
|
Ксилол (диметилбензен) |
C 6 H 4 (CH 3) 2 |
||
|
орто- |
25,18 |
144,41 |
|
|
мета- |
47,87 |
139,10 |
|
|
чифт- |
13,26 |
138,35 |
|
|
Пропилбензен |
C 6 H 5 (CH 2) 2 CH 3 |
99,0 |
159,20 |
|
Кумол (изопропилбензен) |
C6H5CH(CH3)2 |
96,0 |
152,39 |
|
Стирен (винилбензен) |
C6H5CH=CH2 |
30,6 |
145,2 |
Бензол – ниско кипене ( Tбала= 80,1°C), безцветна течност, неразтворима във вода
внимание! Бензол – отрова, засяга бъбреците, променя формулата на кръвта (при продължителна експозиция), може да наруши структурата на хромозомите.
Повечето ароматни въглеводороди са животозастрашаващи и токсични.
Получаване на арени (бензен и неговите хомолози)
В лабораторията
1. Сливане на соли на бензоена киселина с твърди основи
C6H5-COONa + NaOH t → C6H6 + Na2CO3
натриев бензоат
2. Реакция на Wurtz-Fitting: (тук G е халоген)
C 6з 5 -G + 2Na + Р-G →° С 6 з 5 - Р + 2 NaЖ
СЪС 6 H 5 -Cl + 2Na + CH 3 -Cl → C 6 H 5 -CH 3 + 2NaCl
В индустрията
- изолиран от нефт и въглища чрез фракционна дестилация и реформинг;
- от въглищен катран и коксов газ
1. Дехидроциклизация на алканис повече от 6 въглеродни атома:
C6H14 T , кат→C 6 H 6 + 4H 2
2. Тримеризация на ацетилен(само за бензен) – Р. Зелински:
3С 2 H 2 600°° С, акт. въглища→C 6 H 6
3. Дехидрогениранециклохексан и неговите хомолози:
Съветският академик Николай Дмитриевич Зелински установява, че бензолът се образува от циклохексан (дехидрогениране на циклоалкани
C6H12 т, кат→C 6 H 6 + 3H 2

C6H11-CH3 T , кат→C 6 H 5 -CH 3 + 3H 2
метилциклохексантолуен
4. Алкилиране на бензен(получаване на бензенови хомолози) – r Фридел-Крафтс.
C6H6 + C2H5-Cl t, AlCl3→C6H5-C2H5 + HCl
хлороетан етилбензен

Химични свойства на арените
аз. РЕАКЦИИ НА ОКИСЛЕНИЕ
1. Изгаряне (димящ пламък):
2C6H6 + 15O2 T→12CO 2 + 6H 2 O + Q
2. При нормални условия бензенът не обезцветява бромната вода и водния разтвор на калиев перманганат
3. Бензоловите хомолози се окисляват от калиев перманганат (обезцветяване на калиев перманганат):
А) в кисела среда до бензоена киселина
Когато бензеновите хомолози са изложени на калиев перманганат и други силни окислители, страничните вериги се окисляват. Без значение колко сложна е веригата на заместителя, тя се разрушава, с изключение на а-въглеродния атом, който се окислява до карбоксилна група.
Хомолозите на бензена с една странична верига дават бензоена киселина:
Хомолозите, съдържащи две странични вериги, дават двуосновни киселини:
5C 6 H 5 -C 2 H 5 + 12KMnO 4 + 18H 2 SO 4 → 5C 6 H 5 COOH + 5CO 2 + 6K 2 SO 4 + 12MnSO 4 +28H 2 O
5C 6 H 5 -CH 3 + 6KMnO 4 + 9H 2 SO 4 → 5C 6 H 5 COOH + 3K 2 SO 4 + 6MnSO 4 +14H 2 O
Опростено :
C6H5-CH3+3O KMnO4→C 6 H 5 COOH + H 2 O
Б) в неутрални и слабо алкални до бензоена киселина соли
C 6 H 5 -CH 3 + 2KMnO 4 → C 6 H 5 COO K + K OH + 2MnO 2 + H 2 O
II. РЕАКЦИИ НА СЪБИРАНЕ (по-твърди от алкени)
1. Халогениране
C6H6 +3CI2 ч ν → C6H6Cl6 (хексахлорциклохексан - хексахлоран)
2. Хидрогениране
C6H6 + 3H2 T , ПтилиNi→C 6 H 12 (циклохексан)
3. Полимеризация
III. РЕАКЦИИ НА ЗАМЕСТВАНЕ – йонен механизъм (по-лек от алкани)
1. Халогениране -
а ) бензен
C6H6+Cl2 AlCl 3 → C 6 H 5 -Cl + HCl (хлоробензен)
C6H6 + 6Cl2 t,AlCl3→C 6 Cl 6 + 6HCl( хексахлоробензен)
C6H6 + Br2 t,FeCl3→ C 6 H 5 -Br + HBr( бромобензен)
б) бензенови хомолози при облъчване или нагряване
Химичните свойства на алкиловите радикали са подобни на алканите. Водородните атоми в тях се заместват с халоген по свободнорадикален механизъм. Следователно, в отсъствието на катализатор, при нагряване или ултравиолетово облъчване, възниква реакция на радикално заместване в страничната верига. Влиянието на бензеновия пръстен върху алкиловите заместители води до факта, че Водородният атом винаги се замества при въглеродния атом, директно свързан с бензеновия пръстен (а-въглероден атом).
1) C6H5-CH3 + Cl2 ч ν → C 6 H 5 -CH 2 -Cl + HCl
в) хомолози на бензен в присъствието на катализатор
C6H5-CH3 + CI2 AlCl 3 → (орта смес, двойка производни) +HCl
2. Нитриране (с азотна киселина)
C6H6 + HO-NO2 t, H2SO4→ C 6 H 5 -NO 2 + H 2 O
нитробензен - миризма бадеми!
C6H5-CH3 + 3HO-NO2 t, H2SO4→ СЪС H3-C6H2(NO2)3 + 3H2O2,4,6-тринитротолуен (tol, TNT)
Приложение на бензена и неговите хомолози
Бензол C6H6 е добър разтворител. Бензолът като добавка подобрява качеството на моторното гориво. Той служи като суровина за производството на много ароматни органични съединения - нитробензен C 6 H 5 NO 2 (разтворител, от който се получава анилин), хлоробензен C 6 H 5 Cl, фенол C 6 H 5 OH, стирен и др.
Толуен C 6 H 5 –CH 3 – разтворител, използван в производството на багрила, медицински и експлозиви (тротил (TNT), или 2,4,6-тринитротолуен тротил).
Ксилени C6H4(CH3)2. Техническият ксилен е смес от три изомера ( орто-, мета- И двойка-ксилоли) – използва се като разтворител и изходен продукт за синтеза на много органични съединения.
Изопропилбензен C 6 H 5 –CH(CH 3) 2 се използва за получаване на фенол и ацетон.
Хлорирани производни на бензенаизползвани за растителна защита. По този начин продуктът от заместването на Н атоми в бензен с хлорни атоми е хексахлоробензен C 6 Cl 6 - фунгицид; използва се за сухо третиране на семена от пшеница и ръж срещу главня. Продуктът от добавянето на хлор към бензен е хексахлорциклохексан (хексахлоран) C 6 H 6 Cl 6 - инсектицид; използва се за борба с вредните насекоми. Посочените вещества спадат към пестицидите - химически средства за борба с микроорганизми, растения и животни.
стирен C 6 H 5 – CH = CH 2 много лесно полимеризира, образувайки полистирен, а при съполимеризация с бутадиен, стирен-бутадиенови каучуци.
ВИДЕО ИЗЖИВЯВАНИЯ
Първата група реакции са реакциите на заместване. Казахме, че арените нямат множество връзки в структурата на молекулата, но съдържат спрегната система от шест електрона, която е много стабилна и дава допълнителна здравина на бензеновия пръстен. Следователно при химичните реакции първо се извършва заместването на водородните атоми, а не разрушаването на бензеновия пръстен.
Вече сме срещали реакции на заместване, когато говорим за алкани, но при тях тези реакции следват радикален механизъм, докато арените се характеризират с йонен механизъм на реакции на заместване.
Първохимическо свойство халогениране. Заместване на водороден атом с халогенен атом, хлор или бром.
Реакцията протича при нагряване и винаги с участието на катализатор. В случай на хлор, това може да бъде алуминиев хлорид или железен хлорид три. Катализаторът поляризира халогенната молекула, причинявайки разцепване на хетеролитична връзка и произвеждайки йони.
Хлорът е положително зареден йон и реагира с бензен.
Ако реакцията протича с бром, тогава катализаторът е железен бромид или алуминиев бромид.

Важно е да се отбележи, че реакцията протича с молекулярен бром, а не с бромна вода. Бензолът не реагира с бромна вода.
Халогенирането на бензенови хомолози има свои собствени характеристики. В молекулата на толуен метиловата група улеснява заместването в пръстена, реактивността се увеличава и реакцията протича при по-меки условия, тоест при стайна температура.

Важно е да се отбележи, че заместването винаги се случва в орто и пара позиции, така че се получава смес от изомери.
Второсвойство нитриране на бензен, въвеждане на нитро група в бензеновия пръстен.

Образува се тежка жълтеникава течност с мирис на горчиви бадеми нитробензен, така че реакцията може да бъде качествена на бензен. За нитриране се използва нитруваща смес от концентрирани азотна и сярна киселини. Реакцията се извършва чрез нагряване.
Нека ви напомня, че за нитриране на алкани в реакцията на Коновалов се използва разредена азотна киселина без добавяне на сярна киселина.
При нитриране на толуен, както и при халогениране се образува смес от орто- и пара-изомери.

третосвойство алкилиране на бензен с халоалкани.

Тази реакция позволява въвеждането на въглеводороден радикал в бензеновия пръстен и може да се счита за метод за получаване на бензенови хомолози. Алуминиевият хлорид се използва като катализатор, който насърчава разлагането на молекулата на халоалкана в йони. Необходимо е и отопление.
Четвъртосвойство алкилиране на бензен с алкени.

По този начин можете да получите например кумол или етилбензен. Катализатор алуминиев хлорид.
2. Реакции на присъединяване към бензен
Втората група реакции са реакциите на присъединяване. Казахме, че тези реакции не са типични, но са възможни при доста строги условия с разрушаването на пи-електронния облак и образуването на шест сигма връзки.
Петосвойство в общия списък хидрогениране, добавяне на водород.

Температура, налягане, катализатор никел или платина. Толуенът може да реагира по същия начин.
Шестосвойство хлориране. Моля, обърнете внимание, че говорим конкретно за взаимодействие с хлор, тъй като бромът не влиза в тази реакция.
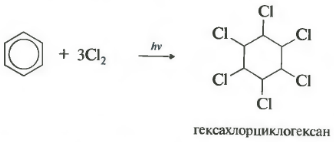
Реакцията протича при силно ултравиолетово облъчване. Образува се хексахлорциклохексан, друго име за хексахлоран, твърдо вещество.
Важно е да запомните, че за бензена невъзможнореакции на присъединяване на халогеноводороди (хидрохалогениране) и присъединяване на вода (хидратация).
3. Заместване в страничната верига на бензенови хомолози
Третата група реакции засяга само бензенови хомолози - това е заместване в страничната верига.
Седмосвойство в общия списък халогениране при алфа въглеродния атом в страничната верига.

Реакцията протича при нагряване или облъчване и винаги само при алфа въглерода. Докато халогенирането продължава, вторият халогенен атом ще се върне в алфа позиция.
4. Окисляване на бензенови хомолози
Четвъртата група реакции е окисление.
Бензеновият пръстен е твърде силен, така че бензенът не се окислявакалиевият перманганат не обезцветява разтвора си. Това е много важно да запомните.
Но хомолозите на бензена се окисляват от подкислен разтвор на калиев перманганат при нагряване. И това е осмото химично свойство.

Това произвежда бензоена киселина. Наблюдава се обезцветяване на разтвора. В този случай, без значение колко дълга е въглеродната верига на заместителя, тя винаги се разкъсва след първия въглероден атом и алфа атомът се окислява до карбоксилна група с образуването на бензоена киселина. Останалата част от молекулата се окислява до съответната киселина или, ако е само един въглероден атом, до въглероден диоксид.
Ако хомологът на бензена има повече от един въглеводороден заместител на ароматния пръстен, тогава окисляването се извършва по същите правила - въглеродът, разположен в алфа позиция, се окислява.

Този пример произвежда двуосновна ароматна киселина, наречена фталова киселина.
Особено бих искал да отбележа окислението на кумол, изопропилбензен, от атмосферен кислород в присъствието на сярна киселина.

Това е така нареченият кумолен метод за производство на фенол. По правило тази реакция се среща при въпроси, свързани с производството на фенол. Това е индустриален метод.
деветосвойство на изгаряне, пълно окисление с кислород. Бензолът и неговите хомолози изгарят до въглероден диоксид и вода.
Нека напишем уравнението на горене на бензен в общ вид.
Според закона за запазване на масата трябва да има толкова атоми отляво, колкото са атомите отдясно. Защото при химичните реакции атомите не изчезват, а просто се променя редът на връзките между тях. Така че ще има толкова молекули въглероден диоксид, колкото въглеродни атоми има в молекулата на арена, тъй като молекулата съдържа един въглероден атом. Тоест n CO 2 молекули. Ще има два пъти по-малко водни молекули от водородните атоми, което е (2n-6)/2, което означава n-3.
Отляво и отдясно има еднакъв брой кислородни атоми. Вдясно има 2n от въглероден диоксид, защото всяка молекула има два кислородни атома, плюс n-3 от вода, за общо 3n-3. Отляво има същия брой кислородни атоми 3n-3, което означава, че има два пъти по-малко молекули, тъй като молекулата съдържа два атома. Това е (3n-3)/2 кислородни молекули.
По този начин ние съставихме уравнение за изгаряне на бензенови хомолози в общ вид.
Съвременната гледна точка за структурата на бензена: плоска молекула, чиито въглеродни атоми са в състояние на sp 2 хибридизация и са комбинирани в правилен шестоъгълник.

Снимка на молекула бензен:
![]()
Ароматност- необичайно ниска енергия на невъзбуденото състояние, причинена от делокализацията на π електрони.
Ароматност- концепция, характеризираща съвкупността от структурни, енергийни свойства и характеристики на реактивност на циклични структури със система от спрегнати връзки
Признаци на ароматностВсяко съединение е ароматно, ако има: а) плосък затворен пръстен; б) спрегната π-електронна система, обхващаща всички атоми от цикъла; в) ако броят на електроните, участващи в конюгацията, съответства на формулата на Хюкел (4n+2., където n е броят на циклите).
Изомерия

Номенклатура

орто-, мета-И чифт-заместен:


Физични свойства
Всички ароматни съединения имат миризма. Бензен, толуен, ксилени, етилбензен,
кумол, стирен - течности, нафталин, антрацен - твърди вещества.
26. Ароматни въглеводороди от бензеновата серия. Номенклатура. Изомерия. Методи за получаване на бензен и неговите хомолози: от каменовъглен катран, ароматизация и дехидроциклизация на парафини, съгласно реакцията на Wurtz-Fittig, алкилиране на Friedel-Crafts с олефини, алкилхалогениди, алкохоли, от соли на бензоена киселина, тримеризация на алкини.
Арените (ароматни въглеводороди) са циклични съединения, чиито молекули съдържат едно или повече бензенови ядра. Емпирична формула на бензен C6H6
Изомерия
Ди-, три- и тетра-заместените ароматни въглеводороди се характеризират с изомерия на позицията на заместителя и изомерия на страничната алкилова верига.

Моно-, пента- и хекса-заместените арени нямат изомери, свързани с позицията на заместителя в пръстена.
Номенклатура
Производните на бензена се наричат заместени бензени. За много от тях се използват или тривиални имена, или заместителят се обозначава с префикс преди думата "бензен". В случай на монозаместени бензени имената не включват числа, тъй като всичките шест въглеродни атома на бензеновата молекула са еквивалентни и е възможен само един монозаместен бензен за всеки заместител.

Ако два заместителя присъстват в молекула на бензен, тогава могат да съществуват три различни дизаместени бензени. Те се наименуват съответно орто-, мета-И чифт-заместен:

Ако бензенът има три или повече заместителя, тогава тяхната позиция в пръстена трябва да бъде обозначена само с цифри. Във всички случаи имената на заместителите са изброени преди думата "бензен" по азбучен ред. Числото 1 в името може да бъде пропуснато, заместителят, от който започва обратното броене, в този случай е включен в основата на името:

Касова бележка:
1. Преработка на каменовъглен катран, дестилация на масло, суха дестилация
дърво
2. Ароматизиране на масло.

3. Дехидроциклизиране на хексан и хептан.
C 6 H 14 → C6H6 + 4H 2
C 7 H 16 → C6H5-CH3 + 4H2
4. Вюрц-Фитиг:

Алкилиране на Фридел-Крафтс. Приети са два възможни механизма на реакция. В първия случай електрофилната частица е карбокатион, образуван в резултат на взаимодействието на халоалкан с алуминиев хлорид (киселина на Люис):
Във втория случай може да се приеме, че електрофилът е алкиловата група на полярния комплекс на AlCl3 с алкилов халид.
Алкилиране на бензен (реакция на Фридел-Крафтс)
C 6 H 6 + C 2 H 5 Cl → C 6 H 5 -C 2 H 5 + HCl
27.Електрофилно заместване в ароматните серии (нитриране, сулфониране, халогениране, алкилиране и ацилиране по Фридел-Крафтс). Концепцията за - и -комплекси. Механизъм на реакциите на електрофилно заместване
Ароматните съединения са тези, чиито молекули съдържат циклична група от атоми със специален модел на свързване - бензенов пръстен. Международното наименование на ароматните въглеводороди е арени.
Най-простият представител на арените е бензенът C 6 H 6 . Формулата, отразяваща структурата на молекулата на бензена, е предложена за първи път от немския химик Кекуле (1865):
Въглеродните атоми в молекулата на бензена образуват правилен плосък шестоъгълник, въпреки че обикновено се рисува като удължен.
Структурата на молекулата на бензена беше окончателно потвърдена от реакцията на нейното образуване от ацетилен. Структурната формула изобразява три единични и три двойни редуващи се въглерод-въглерод връзки. Но такова изображение не предава истинската структура на молекулата. В действителност въглерод-въглеродните връзки в бензена са еквивалентни и имат свойства, които не приличат на тези на единичните или двойните връзки. Тези характеристики се обясняват с електронната структура на молекулата на бензена.
Електронна структура на бензена.
Всеки въглероден атом в бензеновата молекула е в състояние на sp 2 хибридизация. Той е свързан с два съседни въглеродни атома и водороден атом чрез три σ връзки. Резултатът е плосък шестоъгълник: всичките шест въглеродни атома и всички σ-връзки C-C и C-H лежат в една и съща равнина. Електронният облак на четвъртия електрон (р-електрон), който не участва в хибридизацията, има формата на дъмбел и е ориентиран перпендикулярно на равнината на бензеновия пръстен. Такива р-електронни облаци от съседни въглеродни атоми се припокриват над и под равнината на пръстена  . В резултат на това шест р-електрона образуват общ електронен облак и единична химична връзка за всички въглеродни атоми. Две области на голямата електронна равнина са разположени от двете страни на равнината на σ връзка
. В резултат на това шест р-електрона образуват общ електронен облак и единична химична връзка за всички въглеродни атоми. Две области на голямата електронна равнина са разположени от двете страни на равнината на σ връзка  ./>/>
./>/>
стр-Електронният облак причинява намаляване на разстоянието между въглеродните атоми. В молекулата на бензена те са еднакви и равни на 0,14 nm. В случай на единична и двойна връзка, тези разстояния биха били съответно 0,154 и 0,134 nm. Това означава, че в молекулата на бензена няма единични или двойни връзки. Молекулата на бензена е стабилен шестчленен цикъл от еднакви СН групи, разположени в една и съща равнина. Всички връзки между въглеродните атоми в бензена са еквивалентни, което определя характерните свойства на бензеновия пръстен. Това най-точно се отразява от структурната формула на бензена под формата на правилен шестоъгълник с кръг вътре (аз ). (Кръгът символизира еквивалентността на връзките между въглеродните атоми.) Въпреки това, формулата на Кекуле често се използва за обозначаване на двойни връзки ( II
