جزوه برای سخنرانی 5





سخنرانی 5
هیدروکربن های معطر
کلمات کلیدی: هیدروکربن های معطر، آرن ها، هیبریداسیون sp2، ابر تک الکترون p، کونژوگاسیون دایره ای، مکانیسم واکنش جایگزینی یونی، جایگزینی الکتروفیل، نیتراسیون، هالوژناسیون، آلکیلاسیون فریدل کرافت، آلکیلاسیون با آلکن ها، هیدروژناسیون، اکسیداسیون.
ساختار مولکول بنزن. معطر بودن
هیدروکربن های آروماتیک (آرن ها) هیدروکربن هایی هستند که مولکول های آنها حاوی یک یا چند حلقه بنزن است.
ساده ترین نماینده هیدروکربن های معطر، بنزن است که فرمول مولکولی آن C 6 H 6 است. ثابت شده است که تمام اتم های کربن در یک مولکول بنزن در یک صفحه قرار دارند و یک شش ضلعی منظم را تشکیل می دهند (شکل 1). هر اتم کربن به یک اتم هیدروژن پیوند دارد. طول تمام پیوندهای کربن-کربن یکسان است و 0.139 نانومتر است.
فرمول های a) و b) در سال 1865 توسط شیمیدان آلمانی آگوست ککوله پیشنهاد شد. علیرغم این واقعیت که آنها ساختار مولکول بنزن را به طور دقیق منتقل نمی کنند، اما امروزه هنوز از آنها استفاده می شود و فرمول Kekulé نامیده می شود.
از نظر تاریخی، نام «هیدروکربنهای معطر» به این دلیل به وجود آمد که بسیاری از مشتقات بنزن که اولین مشتقات بنزن از منابع طبیعی جدا شده بودند، بوی خوشی داشتند.
در حال حاضر، مفهوم "آروماتیک بودن"، اول از همه، به معنای ماهیت خاص واکنش پذیری مواد است که به نوبه خود با ویژگی های ساختاری مولکول های این ترکیبات تعیین می شود.
این ویژگی ها چیست؟
مطابق با فرمول مولکولی C 6 H 6، بنزن یک ترکیب غیر اشباع است و می توان انتظار داشت که تحت واکنش های افزودن معمولی آلکن ها قرار گیرد. با این حال، در شرایطی که آلکن ها به سرعت تحت واکنش های افزودن قرار می گیرند، بنزن واکنش نشان نمی دهد یا به کندی واکنش نشان می دهد. بنزنواکنشهای کیفی مشخصه هیدروکربنهای غیراشباع را نشان نمیدهد: آن آب برم و محلول آبی پرمنگنات پتاسیم را تغییر رنگ نمی دهد.
این ماهیت واکنش با حضور یک سیستم مزدوج در حلقه معطر توضیح داده می شود - یک واحد پ-ابر الکترونی
در یک مولکول بنزن، هر اتم کربن در حالت است sp 2هیبریداسیون و با سه مرتبط است س- پیوند با دو اتم کربن و یک اتم هیدروژن. چهارمین الکترون ظرفیت اتم کربن روی آن قرار دارد پ- مداری عمود بر صفحه مولکول. همپوشانی جانبی در مولکول بنزن رخ می دهد آر-اوربیتال های هر اتم کربن با آر-اوربیتال های هر دو اتم کربن همسایه (شکل 2). در نتیجه این جفت شدن، الف ابر تک الکترونی p، واقع در بالا و پایین صفحه از حلقه بنزن - انجام می شود رفیق دایره ای.
چنین سیستم چرخه ای با یک ابر مشترک از شش الکترون بسیار پایدار و از نظر انرژی مطلوب است. بنابراین، بنزن ترجیحا وارد آن واکنش هایی می شود که در آن حلقه معطر حفظ می شود.
 آ آ |  ب ب |
برنج. 2. ساختار الکترونیکی مولکول بنزن: الف) طرح همپوشانی آر-اوربیتال ها ب) یک ابر الکترونی واحد.
اجازه دهید یک بار دیگر تأکید کنیم که در یک مولکول بنزن تشخیص سه پیوند دوگانه و سه پیوند منفرد غیرممکن است. چگالی الکترون به طور مساوی در مولکول توزیع می شود و همه پیوندهای بین اتم های کربن دقیقاً یکسان هستند. بنابراین، باید به یاد داشته باشیم که فرمول Kekule، که اغلب برای نشان دادن بنزن استفاده می شود، دلخواه است و ساختار واقعی مولکول آن را منعکس نمی کند.
بنابراین، ترکیبات معطر آنهایی هستند که مولکولهای آنها دارای یک گروه حلقوی پایدار با ویژگی پیوند خاص است. این مواد با داشتن فرمول مولکولی که درجه بالایی از اشباع را نشان می دهد، به عنوان غیراشباع واکنش نشان نمی دهند، اما عمدتاً در واکنش های جایگزینی وارد می شوند و در عین حال سیستم معطر را حفظ می کنند.
همولوگ های بنزن،
ایزومریا، نامگذاری
فرمول کلی سری همولوگ هیدروکربن های آروماتیک C n H 2 n -2 است.
نزدیکترین همولوگ بنزن متیل بنزن است. اغلب آنها از نام بی اهمیت آن - تولوئن استفاده می کنند:

بنزن و تولوئن ایزومرهای آروماتیک ندارند. این مواد فقط مشخص می شوند ایزومریسم بین طبقاتی. بنابراین، هیدروکربنهای غیر حلقوی غیرقابل تبدیل حاوی دو پیوند سهگانه یا دو پیوند دوگانه و یک پیوند سهگانه در مولکول با فرمول مولکولی C 6 H 6 مطابقت دارند و بنابراین، ایزومر به بنزن هستند، برای مثال:
![]()
![]()
با شروع با آرن ها با هشت اتم کربن، احتمال ایزومریسم به دلیل وجود دارد ترکیب و آرایش نسبی رادیکال های هیدروکربنیاگر دو جانشین به حلقه بنزن متصل شوند، می توانند در سه موقعیت مختلف نسبت به یکدیگر قرار گیرند: کنار هم (این موقعیت با پیشوند نشان داده می شود. ارتو-، از طریق یک اتم کربن ( متاو در مقابل یکدیگر ( جفت-). دی متیل بنزن، که فرمول های ساختاری آن ایزومرهای آن در زیر آورده شده است، نامی ساده دارد. زایلن
بنابراین، فرمول مولکولی C 8 H 8 مربوط به چهار هیدروکربن آروماتیک ایزومر است:



مشخصات فیزیکی
بنزن و نزدیکترین همولوگ های آن مایعات بی رنگ با بوی خاصی هستند. هیدروکربن های معطر سبک تر از آب هستند و در آن حل نمی شوند، اما به راحتی در حلال های آلی - الکل، اتر، استون حل می شوند.
بنزن و همولوگ های آن خود حلال های خوبی برای بسیاری از مواد آلی هستند. همه عرصه ها به دلیل محتوای کربن بالا در مولکول هایشان با شعله دودی می سوزند.
خواص فیزیکی برخی از عرصه ها در جدول ارائه شده است.
جدول. خواص فیزیکی برخی از میدان ها
|
نام |
فرمول |
t°.pl., |
t°.b.p.، |
|
بنزن |
C6H6 |
5,5 |
80,1 |
|
تولوئن (متیل بنزن) |
C 6 H 5 CH 3 |
95,0 |
110,6 |
|
اتیل بنزن |
C 6 H 5 C 2 H 5 |
95,0 |
136,2 |
|
زایلن (دی متیل بنزن) |
C 6 H 4 (CH 3) 2 |
||
|
ارتو- |
25,18 |
144,41 |
|
|
متا |
47,87 |
139,10 |
|
|
جفت- |
13,26 |
138,35 |
|
|
پروپیل بنزن |
C 6 H 5 (CH 2) 2 CH 3 |
99,0 |
159,20 |
|
کومن (ایزوپروپیل بنزن) |
C 6 H 5 CH(CH 3) 2 |
96,0 |
152,39 |
|
استایرن (وینیل بنزن) |
C 6 H 5 CH = CH 2 |
30,6 |
145,2 |
بنزن – جوش کم ( تیعدل= 80.1 درجه سانتیگراد)، مایع بی رنگ، نامحلول در آب
توجه! بنزن - سم، بر کلیه ها تأثیر می گذارد، فرمول خون را تغییر می دهد (با قرار گرفتن در معرض طولانی مدت)، می تواند ساختار کروموزوم ها را مختل کند.
بیشتر هیدروکربن های معطر تهدید کننده زندگی و سمی هستند.
تهیه آرن ها (بنزن و همولوگ های آن)
در آزمایشگاه
1. ادغام نمک های اسید بنزوئیک با مواد قلیایی جامد
C6H5-COONa + NaOH t → C 6 H 6 + Na 2 CO 3
بنزوات سدیم
2. واکنش Wurtz-Fitting: (در اینجا G هالوژن است)
ج 6اچ 5 -G + 2Na + آر-G →سی 6 اچ 5 - آر + 2 Naجی
با 6 H 5 -Cl + 2Na + CH 3 -Cl → C 6 H 5 -CH 3 + 2NaCl
در صنعت
- جداسازی شده از نفت و زغال سنگ با تقطیر جزئی و اصلاح.
- از قطران زغال سنگ و گاز کوره کک
1. هیدروسایکل زدایی آلکان هابا بیش از 6 اتم کربن:
C6H14 تی , کت→ C 6 H 6 + 4H 2
2. تریمریزاسیون استیلن(فقط برای بنزن) – آر. زلینسکی:
3С 2 H 2 600 درجهسی، عمل کنید زغال سنگ→ C 6 H 6
3. هیدروژن زداییسیکلوهگزان و همولوگ های آن:
نیکلای دیمیتریویچ زلینسکی، آکادمیک شوروی، ثابت کرد که بنزن از سیکلوهگزان (هیدروژن زدایی سیکلوآلکان ها) تشکیل می شود.
C6H12 تی، کت→ C 6 H 6 + 3H 2

C6H11-CH3 تی , کت→ C 6 H 5 -CH 3 + 3H 2
متیل سیکلوهگزانتولوئن
4. آلکیلاسیون بنزن(تهیه همولوگ های بنزن) – r Friedel-Crafts.
C 6 H 6 + C 2 H 5 -Cl t، AlCl3→C 6 H 5 -C 2 H 5 + HCl
کلرواتان اتیل بنزن

خواص شیمیایی آرن ها
من. واکنش های اکسیداسیون
1. احتراق (شعله دود):
2C6H6 + 15O2 تی→ 12CO 2 + 6H 2 O + Q
2. در شرایط عادی، بنزن آب برم و محلول آبی پرمنگنات پتاسیم را تغییر رنگ نمی دهد.
3. همولوگ های بنزن توسط پرمنگنات پتاسیم اکسید می شوند (پرمنگنات پتاسیم را تغییر رنگ می دهند):
الف) در یک محیط اسیدی به اسید بنزوئیک
هنگامی که همولوگ های بنزن در معرض پرمنگنات پتاسیم و سایر عوامل اکسید کننده قوی قرار می گیرند، زنجیره های جانبی اکسید می شوند. مهم نیست که زنجیره جایگزین چقدر پیچیده باشد، به استثنای اتم کربن a که به یک گروه کربوکسیل اکسید می شود، از بین می رود.
همولوگ های بنزن با یک زنجیره جانبی اسید بنزوئیک می دهند:
همولوگ های حاوی دو زنجیره جانبی اسیدهای دی بازیک می دهند:
5C 6 H 5 -C 2 H 5 + 12KMnO 4 + 18H 2 SO 4 → 5C 6 H 5 COOH + 5CO 2 + 6K 2 SO 4 + 12MnSO 4 + 28H 2 O
5C 6 H 5 -CH 3 + 6KMnO 4 + 9H 2 SO 4 → 5C 6 H 5 COOH + 3K 2 SO 4 + 6MnSO 4 + 14H 2 O
ساده شده :
C6H5-CH3+3O KMnO4→ C 6 H 5 COOH + H 2 O
ب) در نمک های خنثی و کمی قلیایی به اسید بنزوئیک
C 6 H 5 -CH 3 + 2KMnO 4 → C 6 H 5 COO K + K OH + 2MnO 2 + H 2 O
II. واکنش های افزودنی (سخت تر از آلکن ها)
1. هالوژناسیون
C 6 H 6 + 3Cl 2 ساعت ν → C 6 H 6 Cl 6 (هگزا کلرو سیکلوهگزان - هگزاکلران)
2. هیدروژناسیون
C6H6 + 3H2 تی , Ptیانی→ C 6 H 12 (سیکلوهگزان)
3. پلیمریزاسیون
III. واکنش های جایگزینی – مکانیسم یونی (سبک تر از آلکان ها)
1. هالوژناسیون -
آ ) بنزن
C6H6+Cl2 AlCl 3 → C 6 H 5 -Cl + HCl (کلروبنزن)
C6H6 + 6Cl2 t،AlCl3→C 6 Cl 6 + 6HCl( هگزا کلروبنزن)
C 6 H 6 + Br 2 t، FeCl3→ C 6 H 5 -Br + HBr( بروموبنزن)
ب) همولوگ های بنزن در اثر تابش یا حرارت دادن
خواص شیمیایی رادیکال های آلکیل مشابه آلکان ها است. اتم های هیدروژن در آنها با مکانیسم رادیکال آزاد با هالوژن جایگزین می شوند. بنابراین، در غیاب کاتالیزور، با گرم شدن یا تابش اشعه ماوراء بنفش، یک واکنش جایگزینی رادیکال در زنجیره جانبی رخ می دهد. تأثیر حلقه بنزن بر جایگزین های آلکیل منجر به این واقعیت می شود که اتم هیدروژن همیشه در اتم کربنی که مستقیماً به حلقه بنزن متصل است (اتم کربن a-carbon) جایگزین می شود.
1) C 6 H 5 -CH 3 + Cl 2 ساعت ν → C 6 H 5 -CH 2 -Cl + HCl
ج) همولوگ های بنزن در حضور کاتالیزور
C 6 H 5 -CH 3 + Cl 2 AlCl 3 → (مخلوط orta، جفت مشتقات) +HCl
2. نیتراسیون (با اسید نیتریک)
C 6 H 6 + HO-NO 2 t، H2SO4→ C 6 H 5 -NO 2 + H 2 O
نیتروبنزن - بو بادام ها!
C 6 H 5 -CH 3 + 3HO-NO 2 t، H2SO4→ با H 3 -C 6 H 2 (NO 2) 3 + 3H 2 O2،4،6-ترینیتروتولوئن (tol، TNT)
کاربرد بنزن و همولوگ های آن
بنزن C 6 H 6 یک حلال خوب است. بنزن به عنوان یک افزودنی باعث بهبود کیفیت سوخت موتور می شود. به عنوان ماده خام برای تولید بسیاری از ترکیبات آلی معطر - نیتروبنزن C 6 H 5 NO 2 (حلالی که از آن آنیلین به دست می آید)، کلروبنزن C 6 H 5 Cl ، فنل C 6 H 5 OH ، استایرن و غیره استفاده می شود.
تولوئن C 6 H 5 - CH 3 - حلال، مورد استفاده در تولید رنگ، دارویی و مواد منفجره (TNT (TNT) یا 2،4،6-trinitrotoluene TNT).
زایلن ها C6H4(CH3)2. زایلن فنی مخلوطی از سه ایزومر ( ارتو-, متا- و جفتزایلن ها) - به عنوان حلال و محصول اولیه برای سنتز بسیاری از ترکیبات آلی استفاده می شود.
ایزوپروپیل بنزن C 6 H 5 - CH(CH 3) 2 برای تولید فنل و استون استفاده می شود.
مشتقات کلردار بنزنبرای حفاظت از گیاهان استفاده می شود. بنابراین، محصول جایگزینی اتم های H در بنزن با اتم های کلر، هگزاکلروبنزن C 6 Cl 6 - یک قارچ کش است. برای درمان خشک دانه های گندم و چاودار در برابر لجن استفاده می شود. محصول افزودن کلر به بنزن هگزاکلروسیکلوهگزان (هگزاکلران) C 6 H 6 Cl 6 - یک حشره کش است. برای کنترل حشرات مضر استفاده می شود. مواد ذکر شده متعلق به آفت کش ها - ابزارهای شیمیایی برای مبارزه با میکروارگانیسم ها، گیاهان و حیوانات است.
استایرن C 6 H 5 - CH = CH 2 به راحتی پلیمریزه می شود و پلی استایرن را تشکیل می دهد و هنگام کوپلیمریزاسیون با بوتادین، لاستیک های استایرن-بوتادین.
تجربیات ویدیویی
اولین گروه از واکنش ها، واکنش های جانشینی هستند. گفتیم که آرن ها پیوندهای متعددی در ساختار مولکول ندارند، بلکه حاوی یک سیستم مزدوج از شش الکترون هستند که بسیار پایدار است و به حلقه بنزن استحکام بیشتری می بخشد. بنابراین در واکنش های شیمیایی ابتدا جایگزینی اتم های هیدروژن اتفاق می افتد و نه تخریب حلقه بنزن.
ما قبلاً هنگام صحبت در مورد آلکان ها با واکنش های جایگزینی روبرو شده ایم، اما برای آنها این واکنش ها از یک مکانیسم رادیکال پیروی می کنند، در حالی که آرن ها با مکانیسم یونی واکنش های جایگزینی مشخص می شوند.
اولینهالوژناسیون خواص شیمیایی جایگزینی اتم هیدروژن با اتم هالوژن، کلر یا برم.
واکنش هنگام گرم شدن و همیشه با مشارکت یک کاتالیزور رخ می دهد. در مورد کلر، می تواند کلرید آلومینیوم یا کلرید آهن سه باشد. کاتالیزور مولکول هالوژن را قطبی می کند و باعث جدا شدن پیوند هترولیتیک و تولید یون می شود.
کلر یک یون با بار مثبت است و با بنزن واکنش می دهد.
اگر واکنش با برم رخ دهد، کاتالیزور برمید آهن یا برمید آلومینیوم است.

توجه به این نکته ضروری است که واکنش با برم مولکولی و نه با آب برم رخ می دهد. بنزن با آب برم واکنش نمی دهد.
هالوژناسیون همولوگ های بنزن ویژگی های خاص خود را دارد. در مولکول تولوئن، گروه متیل جایگزینی را در حلقه تسهیل می کند، واکنش پذیری افزایش می یابد و واکنش در شرایط ملایم تر، یعنی در دمای اتاق رخ می دهد.

توجه به این نکته ضروری است که جانشینی همیشه در موقعیت های ارتو و پارا اتفاق می افتد، بنابراین مخلوطی از ایزومرها به دست می آید.
دومینخاصیت نیتراسیون بنزن، معرفی یک گروه نیترو به حلقه بنزن.

مایع زردرنگ سنگین با بوی بادام تلخ از نیتروبنزن تشکیل می شود، بنابراین واکنش می تواند کیفی به بنزن باشد. برای نیتراسیون، از مخلوط نیترات کننده اسیدهای نیتریک و سولفوریک غلیظ استفاده می شود. واکنش با حرارت دادن انجام می شود.
اجازه دهید یادآوری کنم که برای نیتراسیون آلکان ها در واکنش کونوالوف، از اسید نیتریک رقیق شده بدون افزودن اسید سولفوریک استفاده شد.
در طی نیتراسیون تولوئن، و همچنین در طول هالوژناسیون، مخلوطی از ارتو- و پارا ایزومرها تشکیل می شود.

سومخاصیت آلکیلاسیون بنزن با هالوآلکان ها

این واکنش اجازه می دهد تا یک رادیکال هیدروکربنی وارد حلقه بنزن شود و می تواند روشی برای تولید همولوگ های بنزن در نظر گرفته شود. کلرید آلومینیوم به عنوان یک کاتالیزور استفاده می شود که باعث تجزیه مولکول هالوآلکان به یون می شود. گرمایش نیز لازم است.
چهارمخاصیت آلکیلاسیون بنزن با آلکن ها

از این طریق می توانید به عنوان مثال کومن یا اتیل بنزن را بدست آورید. کاتالیست آلومینیوم کلرید.
2. واکنش های افزودن به بنزن
گروه دوم واکنش ها، واکنش های افزایشی هستند. گفتیم که این واکنشها معمولی نیستند، اما در شرایط نسبتاً سخت با تخریب ابر پی الکترونی و تشکیل پیوندهای شش سیگما امکانپذیر هستند.
پنجمخواص در لیست کلی هیدروژناسیون، اضافه کردن هیدروژن.

دما، فشار، کاتالیزور نیکل یا پلاتین. تولوئن می تواند به همین روش واکنش نشان دهد.
ششمکلرزنی دارایی لطفا توجه داشته باشید که ما به طور خاص در مورد تعامل با کلر صحبت می کنیم، زیرا برم وارد این واکنش نمی شود.
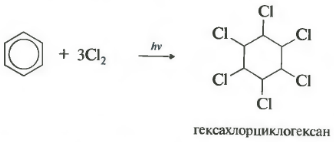
واکنش تحت تابش شدید فرابنفش رخ می دهد. هگزاکلرو سیکلوهگزان، نام دیگر هگزاکلران، یک جامد، تشکیل شده است.
مهم است که به یاد داشته باشید که برای بنزن ممکن نیستواکنش های افزودن هالیدهای هیدروژن (هیدروهالوژناسیون) و افزودن آب (هیدراتاسیون).
3. جایگزینی در زنجیره جانبی همولوگ های بنزن
گروه سوم واکنش ها فقط به همولوگ های بنزن مربوط می شود - این یک جایگزینی در زنجیره جانبی است.
هفتمویژگی در فهرست کلی هالوژناسیون در اتم کربن آلفا در زنجیره جانبی.

واکنش زمانی رخ می دهد که حرارت داده شود یا تحت تابش قرار گیرد و همیشه فقط در کربن آلفا باشد. با ادامه هالوژناسیون، اتم دوم هالوژن به موقعیت آلفا باز می گردد.
4. اکسیداسیون همولوگ های بنزن
گروه چهارم واکنش ها اکسیداسیون است.
حلقه بنزن خیلی قوی است، بنابراین بنزن است اکسید نمی شودپرمنگنات پتاسیم محلول آن را تغییر رنگ نمی دهد. این بسیار مهم است که به خاطر بسپارید.
اما همولوگ های بنزن با یک محلول اسیدی از پرمنگنات پتاسیم هنگام گرم شدن اکسید می شوند. و این هشتمین خاصیت شیمیایی است.

این باعث تولید اسید بنزوئیک می شود. تغییر رنگ محلول مشاهده می شود. در این حالت، مهم نیست که زنجیره کربنی جانشین چقدر طولانی باشد، همیشه پس از اولین اتم کربن می شکند و اتم آلفا با تشکیل اسید بنزوئیک به یک گروه کربوکسیل اکسید می شود. باقی مانده مولکول به اسید مربوطه یا اگر فقط یک اتم کربن باشد به دی اکسید کربن اکسید می شود.
اگر یک همولوگ بنزن بیش از یک جایگزین هیدروکربن روی حلقه معطر داشته باشد، اکسیداسیون طبق همان قوانین اتفاق می افتد - کربن واقع در موقعیت آلفا اکسید می شود.

این مثال یک اسید آروماتیک دوبازیک به نام اسید فتالیک تولید می کند.
من به ویژه می خواهم به اکسیداسیون کومن، ایزوپروپیل بنزن، توسط اکسیژن اتمسفر در حضور اسید سولفوریک اشاره کنم.

این روش به اصطلاح کیومن برای تولید فنل است. قاعدتاً در مسائل مربوط به تولید فنل با این واکنش مواجه می شود. این یک روش صنعتی است.
نهماحتراق خاصیت، اکسیداسیون کامل با اکسیژن. بنزن و همولوگ های آن به دی اکسید کربن و آب می سوزند.
اجازه دهید معادله احتراق بنزن را به صورت کلی بنویسیم.
طبق قانون بقای جرم، باید به تعداد اتم های سمت راست در سمت چپ اتم وجود داشته باشد. زیرا در واکنش های شیمیایی، اتم ها ناپدید نمی شوند، بلکه ترتیب پیوند بین آنها به سادگی تغییر می کند. بنابراین به تعداد اتم های کربن در مولکول آرن، مولکول دی اکسید کربن وجود خواهد داشت، زیرا مولکول حاوی یک اتم کربن است. یعنی n مولکول CO 2. مولکول های آب دو برابر کمتر از اتم های هیدروژن خواهد بود، یعنی (2n-6)/2، که به معنای n-3 است.
در سمت چپ و راست به همان تعداد اتم اکسیژن وجود دارد. در سمت راست 2n از دی اکسید کربن وجود دارد، زیرا هر مولکول دارای دو اتم اکسیژن به اضافه n-3 از آب است که در مجموع 3n-3 است. در سمت چپ همان تعداد اتم های اکسیژن 3n-3 وجود دارد، به این معنی که مولکول های دو برابر کمتر است، زیرا مولکول حاوی دو اتم است. یعنی (3n-3)/2 مولکول اکسیژن.
بنابراین، ما معادله ای برای احتراق همولوگ های بنزن به شکل کلی جمع آوری کرده ایم.
دیدگاه مدرن در مورد ساختار بنزن: یک مولکول مسطح که اتم های کربن آن در حالت هیبریداسیون sp 2 قرار دارند و در یک شش ضلعی منظم ترکیب می شوند.

تصویر یک مولکول بنزن:
![]()
معطر بودن- انرژی کم غیرمعمول حالت تحریک نشده ناشی از جابجایی الکترون های π.
معطر بودن- مفهومی که مجموع خواص ساختاری، انرژی و ویژگی های واکنش پذیری ساختارهای حلقوی با سیستم پیوندهای مزدوج را مشخص می کند.
نشانه های معطر بودنهر ترکیبی معطر است اگر دارای: الف) یک حلقه مسطح بسته باشد. ب) یک سیستم π-الکترون مزدوج که تمام اتم های چرخه را پوشش می دهد. ج) اگر تعداد الکترون های درگیر در صرف با فرمول هوکل مطابقت داشته باشد (4n+2.، که در آن n تعداد چرخه ها است).
ایزومریسم

نامگذاری

ارتو-, متاو جفت-جایگزین:


مشخصات فیزیکی
تمام ترکیبات معطر دارای بو هستند. بنزن، تولوئن، زایلن، اتیل بنزن،
کومن، استایرن - مایعات، نفتالین، آنتراسن - جامدات.
26. هیدروکربن های معطر از سری بنزن. نامگذاری. ایزومریسم روش های به دست آوردن بنزن و همولوگ های آن: از قطران زغال سنگ، آروماتیزاسیون و چرخه زدایی پارافین ها، طبق واکنش Wurtz-Fittig، آلکیلاسیون فریدل کرافت با الفین ها، آلکیل هالیدها، الکل ها، از نمک های اسید بنزوئیک، تریمریزاسیون آلکین ها.
آرن ها (هیدروکربن های معطر) ترکیبات حلقویی هستند که مولکول های آنها حاوی یک یا چند هسته بنزن است. فرمول تجربی بنزن C6H6
ایزومریسم
هیدروکربن های آروماتیک دی، سه و چهار جانشین شده با ایزومریسم موقعیت جانشین و ایزومریسم زنجیره جانبی آلکیل مشخص می شوند.

آرن های تک، پنتا و هگزا جایگزین ایزومرهای مرتبط با موقعیت جانشین در حلقه ندارند.
نامگذاری
مشتقات بنزن را بنزن های جایگزین می گویند. برای بسیاری از آنها، یا از نام های بی اهمیت استفاده می شود، یا جایگزین با پیشوندی قبل از کلمه "بنزن" نشان داده می شود. در مورد بنزن های تک جایگزین، نام ها شامل اعداد نمی شوند، زیرا هر شش اتم کربن مولکول بنزن معادل هستند و تنها یک بنزن تک جایگزین برای هر جایگزین امکان پذیر است.

اگر دو جانشین بر روی یک مولکول بنزن وجود داشته باشد، در این صورت سه بنزن متفاوت جایگزین میتوانند وجود داشته باشند. بر این اساس نامگذاری شده اند ارتو-, متاو جفت-جایگزین:

اگر بنزن دارای سه یا چند جایگزین باشد، موقعیت آنها در حلقه باید فقط با اعداد نشان داده شود. در همه موارد، نام جایگزین ها قبل از کلمه "بنزن" به ترتیب حروف الفبا ذکر شده است. عدد 1 در نام ممکن است حذف شود؛ جایگزینی که شمارش معکوس از آن شروع می شود در این مورد در اساس نام گنجانده شده است:

اعلام وصول:
1. فرآوری قطران زغال سنگ، تقطیر روغن، تقطیر خشک
چوب
2. معطر کردن روغن.

3. چرخه زدایی از هگزان و هپتان.
C 6 H 14 → C6H6 + 4H 2
C 7 H 16 → C6H5-CH3 + 4H2
4. ورتز فیتیگ:

آلکیلاسیون Friedel–Crafts. دو مکانیسم واکنش ممکن پذیرفته شده است. در حالت اول، ذره الکتروفیل یک کربوکاتیون است که در نتیجه برهمکنش یک هالوآلکان با کلرید آلومینیوم (اسید لوئیس) ایجاد شده است.
در حالت دوم، می توان فرض کرد که الکتروفیل گروه آلکیل کمپلکس قطبی AlCl 3 با یک آلکیل هالید است.
آلکیلاسیون بنزن (واکنش فریدل کرافت)
C 6 H 6 + C 2 H 5 Cl → C 6 H 5 - C 2 H 5 + HCl
27جایگزینی الکتروفیل در سری آروماتیک (نیتراسیون، سولفوناسیون، هالوژناسیون، آلکیلاسیون و آسیلاسیون فریدل کرافت). مفهوم مجتمع های - و -. مکانیسم واکنش های جایگزینی الکتروفیل
ترکیبات معطر آنهایی هستند که مولکولهای آنها شامل یک گروه حلقوی از اتمها با الگوی پیوند خاص - یک حلقه بنزن است. نام بین المللی هیدروکربن های آروماتیک arenes است.
ساده ترین نماینده آرن ها بنزن C 6 H 6 است. فرمول منعکس کننده ساختار مولکول بنزن برای اولین بار توسط شیمیدان آلمانی Kekule (1865) ارائه شد:
اتم های کربن موجود در مولکول بنزن یک شش ضلعی مسطح منظم را تشکیل می دهند، اگرچه معمولاً به صورت کشیده کشیده می شود.
ساختار مولکول بنزن در نهایت با واکنش تشکیل آن از استیلن تأیید شد. فرمول ساختاری سه پیوند کربن-کربن متناوب منفرد و سه پیوند دوگانه را نشان می دهد. اما چنین تصویری ساختار واقعی مولکول را بیان نمی کند. در واقع، پیوندهای کربن-کربن در بنزن معادل هستند و خواصی متفاوت با پیوندهای تک یا دوگانه دارند. این ویژگی ها با ساختار الکترونیکی مولکول بنزن توضیح داده می شود.
ساختار الکترونیکی بنزن
هر اتم کربن در یک مولکول بنزن در حالت هیبریداسیون sp 2 قرار دارد. با سه پیوند σ به دو اتم کربن مجاور و یک اتم هیدروژن متصل است. نتیجه یک شش ضلعی مسطح است: تمام شش اتم کربن و همه پیوندهای σ C-C و C-H در یک صفحه قرار دارند. ابر الکترونی الکترون چهارم (الکترون p) که در هیبریداسیون دخالتی ندارد، شکل یک دمبل دارد و عمود بر صفحه حلقه بنزن جهت گیری می کند. چنین ابرهای الکترونی p از اتم های کربن همسایه در بالا و زیر صفحه حلقه همپوشانی دارند  . در نتیجه، شش الکترون p یک ابر الکترونی مشترک و یک پیوند شیمیایی واحد برای همه اتمهای کربن تشکیل میدهند. دو ناحیه از صفحه الکترونی بزرگ در دو طرف صفحه پیوند σ قرار دارند
. در نتیجه، شش الکترون p یک ابر الکترونی مشترک و یک پیوند شیمیایی واحد برای همه اتمهای کربن تشکیل میدهند. دو ناحیه از صفحه الکترونی بزرگ در دو طرف صفحه پیوند σ قرار دارند  ./>/>
./>/>
پ-ابر الکترونی باعث کاهش فاصله بین اتم های کربن می شود. در یک مولکول بنزن آنها یکسان و برابر با 0.14 نانومتر هستند. در مورد پیوند یک و دو، این فواصل به ترتیب 0.154 و 0.134 نانومتر خواهد بود. این بدان معناست که هیچ پیوند منفرد یا دوگانه ای در مولکول بنزن وجود ندارد. مولکول بنزن یک چرخه شش عضوی پایدار از گروههای CH یکسان است که در یک صفحه قرار دارند. همه پیوندهای بین اتم های کربن در بنزن معادل هستند که ویژگی های مشخصه حلقه بنزن را تعیین می کند. این با فرمول ساختاری بنزن به شکل یک شش ضلعی منتظم با یک دایره در داخل (من ). (دایره نماد هم ارزی پیوندهای بین اتم های کربن است.) با این حال، فرمول Kekule اغلب برای نشان دادن پیوندهای دوگانه استفاده می شود. II
