W lekcji 13 „” z kursu ” Chemia dla opornych» rozważyć, dlaczego potrzebne są równania chemiczne; Nauczmy się wyrównywać reakcje chemiczne poprzez prawidłowe ułożenie współczynników. Ta lekcja będzie wymagała od ciebie znajomości podstaw chemii z poprzednich lekcji. Koniecznie przeczytaj o analizie elementarnej, aby uzyskać szczegółowe spojrzenie na wzory empiryczne i analizę chemiczną.
W wyniku reakcji spalania metanu CH 4 w tlenie O 2 powstają dwutlenek węgla CO 2 i woda H 2 O. Reakcję tę można opisać równanie chemiczne:
- CH 4 + O 2 → CO 2 + H 2 O (1)
Spróbujmy wydobyć więcej informacji z równania chemicznego niż tylko wskazanie produkty i odczynniki reakcje. Równanie chemiczne (1) jest NIEkompletne i dlatego nie dostarcza informacji o tym, ile cząsteczek O 2 zużywa się na 1 cząsteczkę CH 4 i ile cząsteczek CO 2 i H2 O powstaje w rezultacie. Ale jeśli zapiszemy współczynniki liczbowe przed odpowiednimi wzorami cząsteczkowymi, które wskazują, ile cząsteczek każdego typu bierze udział w reakcji, wówczas otrzymamy pełne równanie chemiczne reakcje.
Aby dokończyć skład równania chemicznego (1), należy pamiętać o jednej prostej zasadzie: lewa i prawa strona równania musi zawierać taką samą liczbę atomów każdego typu, gdyż podczas reakcji chemicznej nie powstają żadne nowe atomy tworzone, a istniejące nie ulegają zniszczeniu. Zasada ta opiera się na prawie zachowania masy, o którym mówiliśmy na początku rozdziału.
Jest to konieczne, aby uzyskać pełne równanie z prostego równania chemicznego. Przejdźmy więc do właściwego równania reakcji (1): spójrzmy jeszcze raz na równanie chemiczne, dokładnie na atomy i cząsteczki po prawej i lewej stronie. Łatwo zauważyć, że w reakcji biorą udział trzy rodzaje atomów: węgiel C, wodór H i tlen O. Policzmy i porównajmy liczbę atomów każdego rodzaju po prawej i lewej stronie równania chemicznego.
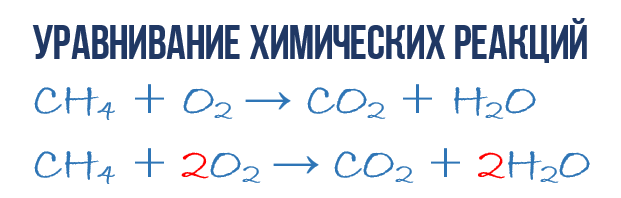
Zacznijmy od węgla. Po lewej stronie jeden atom C jest częścią cząsteczki CH4, a po prawej stronie jeden atom C jest częścią CO2. Zatem po lewej i prawej stronie liczba atomów węgla jest taka sama, więc zostawiamy to w spokoju. Ale dla jasności postawmy współczynnik 1 przed cząsteczkami z węglem, chociaż nie jest to konieczne:
- 1CH 4 + O 2 → 1CO 2 + H 2 O (2)
Następnie przechodzimy do liczenia atomów wodoru H. Po lewej stronie w cząsteczce CH 4 znajdują się 4 atomy H (w sensie ilościowym H 4 = 4H), a po prawej stronie są tylko 2 atomy H w cząsteczce Cząsteczka H 2 O, której jest dwa razy mniej niż po lewej stronie równania chemicznego (2). Wyrównajmy! Aby to zrobić, umieśćmy współczynnik 2 przed cząsteczką H 2 O. Teraz będziemy mieć 4 cząsteczki wodoru H zarówno w reagentach, jak i produktach:
- 1CH 4 + O 2 → 1CO 2 + 2H 2 O (3)
Należy pamiętać, że współczynnik 2, który zapisaliśmy przed cząsteczką wody H 2 O w celu wyrównania wodoru H, zwiększa 2-krotnie wszystkie atomy zawarte w jej składzie, tj. 2H 2 O oznacza 4H i 2O. OK, wydaje się, że już to wyjaśniliśmy, pozostaje tylko policzyć i porównać liczbę atomów tlenu O w równaniu chemicznym (3). Od razu rzuca się w oczy fakt, że po lewej stronie jest dokładnie 2 razy mniej atomów O niż po prawej. Teraz już wiesz, jak samodzielnie bilansować równania chemiczne, więc od razu napiszę wynik końcowy:
- 1CH 4 + 2O 2 → 1CO 2 + 2H 2 O lub CH 4 + 2O 2 → CO 2 + 2H 2 O (4)
Jak widać, wyrównywanie reakcji chemicznych nie jest taką trudną sprawą i nie chemia jest tu istotna, ale matematyka. Równanie (4) nazywa się pełne równanie reakcja chemiczna, gdyż podlega prawu zachowania masy, tj. liczba atomów każdego typu wchodzących w reakcję dokładnie pokrywa się z liczbą atomów tego typu na końcu reakcji. Każda strona tego pełnego równania chemicznego zawiera 1 atom węgla, 4 atomy wodoru i 4 atomy tlenu. Warto jednak zrozumieć kilka ważnych punktów: reakcja chemiczna to złożona sekwencja poszczególnych etapów pośrednich, dlatego na przykład równania (4) nie można interpretować w tym sensie, że 1 cząsteczka metanu musi jednocześnie zderzyć się z 2 cząsteczkami tlenu Cząsteczki. Procesy zachodzące podczas powstawania produktów reakcji są znacznie bardziej złożone. Punkt drugi: pełne równanie reakcji nie mówi nam nic o jej mechanizmie molekularnym, czyli o sekwencji zdarzeń zachodzących na poziomie molekularnym podczas jej wystąpienia.
Współczynniki w równaniach reakcji chemicznych
Kolejny wyraźny przykład prawidłowego ułożenia szanse w równaniach reakcji chemicznych: Trinitrotoluen (TNT) C 7 H 5 N 3 O 6 łączy się energicznie z tlenem, tworząc H 2 O, CO 2 i N 2. Zapiszmy równanie reakcji, które wyrównamy:
- C 7 H 5 N 3 O 6 + O 2 → CO 2 + H 2 O + N 2 (5)
Łatwiej jest skonstruować pełne równanie na podstawie dwóch cząsteczek TNT, ponieważ lewa strona zawiera nieparzystą liczbę atomów wodoru i azotu, a prawa strona zawiera liczbę parzystą:
- 2C 7 H 5 N 3 O 6 + O 2 → CO 2 + H 2 O + N 2 (6)
Wtedy jest jasne, że 14 atomów węgla, 10 atomów wodoru i 6 atomów azotu musi przekształcić się w 14 cząsteczek dwutlenku węgla, 5 cząsteczek wody i 3 cząsteczki azotu:
- 2C 7 H 5 N 3 O 6 + O 2 → 14CO 2 + 5H 2 O + 3N 2 (7)
Teraz obie części zawierają tę samą liczbę wszystkich atomów z wyjątkiem tlenu. Z 33 atomów tlenu znajdujących się po prawej stronie równania, 12 jest dostarczanych przez dwie pierwotne cząsteczki TNT, a pozostałe 21 musi być dostarczane przez 10,5 cząsteczek O2. Zatem pełne równanie chemiczne będzie wyglądać następująco:
- 2C 7 H 5 N 3 O 6 + 10,5O 2 → 14CO 2 + 5H 2 O + 3N 2 (8)
Możesz pomnożyć obie strony przez 2 i pozbyć się niecałkowitego współczynnika 10,5:
- 4C 7 H 5 N 3 O 6 + 21O 2 → 28CO 2 + 10H 2 O + 6N 2 (9)
Ale nie trzeba tego robić, ponieważ wszystkie współczynniki równania nie muszą być liczbami całkowitymi. Jeszcze bardziej poprawne byłoby utworzenie równania opartego na jednej cząsteczce TNT:
- C 7 H 5 N 3 O 6 + 5,25O 2 → 7CO 2 + 2,5H 2 O + 1,5N 2 (10)
Pełne równanie chemiczne (9) zawiera wiele informacji. Przede wszystkim wskazuje substancje wyjściowe - odczynniki, I produkty reakcje. Ponadto pokazuje, że podczas reakcji wszystkie atomy każdego typu są indywidualnie zachowywane. Jeśli pomnożymy obie strony równania (9) przez liczbę Avogadra N A = 6,022 10 23, możemy stwierdzić, że 4 mole TNT reagują z 21 molami O 2, tworząc 28 moli CO 2, 10 moli H 2 O i 6 mole N2.
Jest jeszcze jeden trik. Korzystając z układu okresowego, określamy masy cząsteczkowe wszystkich tych substancji:
- C 7 H 5 N 3 O 6 = 227,13 g/mol
- O2 = 31,999 g/mol
- CO2 = 44,010 g/mol
- H2O = 18,015 g/mol
- N2 = 28,013 g/mol
Teraz równanie 9 wskaże również, że 4 227,13 g = 908,52 g TNT wymaga 21 31,999 g = 671,98 g tlenu do zakończenia reakcji i w rezultacie powstaje 28 44,010 g = 1232,3 g CO 2, 10·18,015 g = 180,15 g H2O i 6,28,013 g = 168,08 g N2. Sprawdźmy, czy w tej reakcji jest spełniona zasada zachowania masy:
| Odczynniki | Produkty | |
| 908,52 g trotylu | 1232,3 g CO2 | |
| 671,98 g CO2 | 180,15 g H2O | |
| 168,08 g N2 | ||
| Całkowity | 1580,5 g | 1580,5 g |
Jednak poszczególne cząsteczki niekoniecznie muszą brać udział w reakcji chemicznej. Na przykład reakcja wapienia CaCO3 i kwasu solnego HCl, w wyniku której powstaje wodny roztwór chlorku wapnia CaCl2 i dwutlenku węgla CO2:
- CaCO 3 + 2HCl → CaCl 2 + CO 2 + H 2 O (11)
Równanie chemiczne (11) opisuje reakcję węglanu wapnia CaCO 3 (wapień) i kwasu solnego HCl, w wyniku której powstaje wodny roztwór chlorku wapnia CaCl 2 i dwutlenku węgla CO 2. To równanie jest kompletne, ponieważ liczba atomów każdego typu po jego lewej i prawej stronie jest taka sama.
Znaczenie tego równania jest takie poziom makroskopowy (molowy). jest następująca: 1 mol lub 100,09 g CaCO3 wymaga 2 moli, czyli 72,92 g HCl, aby zakończyć reakcję, w wyniku czego powstaje 1 mol CaCl2 (110,99 g/mol), CO2 (44,01 g/mol) i H2 O (18,02 g/mol). Na podstawie tych danych liczbowych łatwo jest sprawdzić, czy w tej reakcji spełniona jest zasada zachowania masy.
Interpretacja równania (11) na poziomie mikroskopowym (molekularnym). nie jest to takie oczywiste, ponieważ węglan wapnia jest solą, a nie związkiem molekularnym, dlatego równania chemicznego (11) nie można rozumieć w tym sensie, że 1 cząsteczka węglanu wapnia CaCO 3 reaguje z 2 cząsteczkami HCl. Co więcej, cząsteczka HCl w roztworze na ogół dysocjuje (rozpada się) na jony H + i Cl -. Zatem bardziej poprawny opis tego, co dzieje się w tej reakcji na poziomie molekularnym, daje równanie:
- CaCO 3 (roztwór) + 2H + (wodny) → Ca 2+ (wodny) + CO 2 (g.) + H 2 O (l.) (12)
Tutaj stan fizyczny każdego rodzaju cząstek jest krótko wskazany w nawiasach ( telewizja- twardy, woda- jon uwodniony w roztworze wodnym, G.- gaz, I.- płyn).
Równanie (12) pokazuje, że stały CaCO 3 reaguje z dwoma uwodnionymi jonami H +, tworząc jon dodatni Ca 2+, CO 2 i H 2 O. Równanie (12), podobnie jak inne kompletne równania chemiczne, nie daje wyobrażenia o mechanizm molekularny reaguje i jest mniej wygodny do liczenia ilości substancji, daje jednak lepszy opis tego, co dzieje się na poziomie mikroskopowym.
Wzmocnij swoją wiedzę na temat tworzenia równań chemicznych, samodzielnie przepracowując przykład z rozwiązaniem:
Mam nadzieję, że z lekcji 13” Pisanie równań chemicznych„Nauczyłeś się czegoś nowego dla siebie. Jeśli masz jakieś pytania, napisz je w komentarzach.
Dość często uczniowie i studenci muszą komponować tzw. równania reakcji jonowych. W szczególności zadanie 31, zaproponowane na Unified State Exam in Chemistry, poświęcone jest temu tematowi. W tym artykule szczegółowo omówimy algorytm pisania krótkich i pełnych równań jonowych oraz przeanalizujemy wiele przykładów o różnym stopniu złożoności.
Dlaczego potrzebne są równania jonowe?
Przypomnę, że gdy w wodzie (i nie tylko!) rozpuszcza się wiele substancji, następuje proces dysocjacji – substancje rozpadają się na jony. Na przykład cząsteczki HCl w środowisku wodnym dysocjują na kationy wodoru (H +, a dokładniej H 3 O +) i aniony chloru (Cl -). Bromek sodu (NaBr) występuje w roztworze wodnym nie w postaci cząsteczek, ale w postaci uwodnionych jonów Na + i Br - (nawiasem mówiąc, stały bromek sodu zawiera również jony).
Pisząc równania „zwykłe” (molekularne) nie bierzemy pod uwagę, że reagują nie cząsteczki, ale jony. Oto na przykład jak wygląda równanie reakcji kwasu solnego i wodorotlenku sodu:
HCl + NaOH = NaCl + H 2 O. (1)
Oczywiście ten diagram nie opisuje procesu całkowicie poprawnie. Jak już powiedzieliśmy, w roztworze wodnym praktycznie nie ma cząsteczek HCl, ale są jony H + i Cl -. To samo dotyczy NaOH. Bardziej poprawne byłoby napisanie co następuje:
H + + Cl - + Na + + OH - = Na + + Cl - + H 2 O. (2)
To jest to pełne równanie jonowe. Zamiast „wirtualnych” cząsteczek widzimy cząsteczki, które faktycznie są obecne w roztworze (kationy i aniony). Nie będziemy rozwodzić się nad pytaniem, dlaczego napisaliśmy H 2 O w formie molekularnej. Zostanie to wyjaśnione nieco później. Jak widać, nie ma nic skomplikowanego: zastąpiliśmy cząsteczki jonami, które powstają podczas ich dysocjacji.
Jednak nawet pełne równanie jonowe nie jest idealne. Rzeczywiście, przyjrzyj się bliżej: zarówno lewa, jak i prawa strona równania (2) zawierają te same cząstki - kationy Na + i Cl - aniony. Jony te nie zmieniają się podczas reakcji. Dlaczego więc są w ogóle potrzebne? Usuńmy je i zdobądźmy Krótkie równanie jonowe:
H + + OH - = H 2 O. (3)
Jak widać wszystko sprowadza się do oddziaływania jonów H+ i OH - z powstawaniem wody (reakcja neutralizacji).
Wszystkie kompletne i krótkie równania jonowe są spisane. Gdybyśmy rozwiązali zadanie 31 na egzaminie Unified State Exam z chemii, otrzymalibyśmy za to maksymalną liczbę punktów – 2 punkty.
A więc jeszcze raz o terminologii:
- HCl + NaOH = NaCl + H 2 O - równanie molekularne („zwykłe” równanie, schematycznie odzwierciedlające istotę reakcji);
- H + + Cl - + Na + + OH - = Na + + Cl - + H 2 O - pełne równanie jonowe (widoczne są rzeczywiste cząstki w roztworze);
- H + + OH - = H 2 O - krótkie równanie jonowe (usunęliśmy wszystkie „śmieci” - cząstki nie biorące udziału w procesie).
Algorytm zapisu równań jonowych
- Utwórzmy równanie molekularne reakcji.
- Wszystkie cząstki, które w roztworze dysocjują w zauważalnym stopniu, są zapisane w postaci jonów; substancje, które nie są podatne na dysocjację, pozostają „w postaci cząsteczek”.
- Z obu części równania usuwamy tzw. jony obserwatora, czyli cząstki nie biorące udziału w procesie.
- Sprawdzamy współczynniki i otrzymujemy ostateczną odpowiedź - krótkie równanie jonowe.
Przykład 1. Napisz pełne i krótkie równania jonowe opisujące oddziaływanie wodnych roztworów chlorku baru i siarczanu sodu.
Rozwiązanie. Będziemy działać zgodnie z zaproponowanym algorytmem. Stwórzmy najpierw równanie molekularne. Chlorek baru i siarczan sodu to dwie sole. Spójrzmy na sekcję podręcznika „Właściwości związków nieorganicznych”. Widzimy, że sole mogą oddziaływać ze sobą, jeśli podczas reakcji wytrąci się osad. Sprawdźmy:
Ćwiczenie 2. Uzupełnij równania następujących reakcji:
- KOH + H2SO4 =
- H3PO4 + Na2O=
- Ba(OH)2 + CO2 =
- NaOH + CuBr2 =
- K 2 S + Hg(NO 3) 2 =
- Zn + FeCl2 =
Ćwiczenie 3. Zapisz równania molekularne reakcji (w roztworze wodnym) pomiędzy: a) węglanem sodu i kwasem azotowym, b) chlorkiem niklu(II) i wodorotlenkiem sodu, c) kwasem fosforowym i wodorotlenkiem wapnia, d) azotanem srebra i chlorkiem potasu, e ) tlenek fosforu (V) i wodorotlenek potasu.
Mam szczerą nadzieję, że wykonanie tych trzech zadań nie sprawi Państwu żadnych problemów. Jeśli tak nie jest, należy wrócić do tematu „Właściwości chemiczne głównych klas związków nieorganicznych”.
Jak zamienić równanie molekularne w pełne równanie jonowe
Zaczyna się zabawa. Musimy zrozumieć, które substancje należy zapisać jako jony, a które pozostawić w „formie molekularnej”. Będziesz musiał pamiętać o następujących kwestiach.
W postaci jonów napisz:
- sole rozpuszczalne (podkreślam, tylko sole dobrze rozpuszczalne w wodzie);
- zasady (przypomnę, że zasady to zasady rozpuszczalne w wodzie, ale nie NH 4 OH);
- mocne kwasy (H 2 SO 4, HNO 3, HCl, HBr, HI, HClO 4, HClO 3, H 2 SeO 4, ...).
Jak widać, zapamiętanie tej listy wcale nie jest trudne: obejmuje mocne kwasy i zasady oraz wszystkie rozpuszczalne sole. Nawiasem mówiąc, szczególnie czujnym młodym chemikom, których może oburzyć fakt, że na tej liście nie znajdują się mocne elektrolity (nierozpuszczalne sole), mogę powiedzieć, co następuje: NIEumieszczenie na tej liście soli nierozpuszczalnych wcale nie zaprzecza fakt, że są to mocne elektrolity.
Wszystkie inne substancje muszą być obecne w równaniach jonowych w postaci cząsteczek. Dla wymagających czytelników, których nie zadowala niejasne określenie „wszystkie inne substancje” i którzy wzorem bohatera słynnego filmu domagają się „ogłoszenia pełnej listy”, podaję następującą informację.
W postaci cząsteczek napisz:
- wszystkie nierozpuszczalne sole;
- wszystkie słabe zasady (w tym nierozpuszczalne wodorotlenki, NH 4OH i podobne substancje);
- wszystkie słabe kwasy (H 2 CO 3, HNO 2, H 2 S, H 2 SiO 3, HCN, HClO, prawie wszystkie kwasy organiczne...);
- ogólnie wszystkie słabe elektrolity (łącznie z wodą!!!);
- tlenki (wszystkie rodzaje);
- wszystkie związki gazowe (w szczególności H 2, CO 2, SO 2, H 2 S, CO);
- substancje proste (metale i niemetale);
- prawie wszystkie związki organiczne (z wyjątkiem rozpuszczalnych w wodzie soli kwasów organicznych).
Uff, wygląda na to, że o niczym nie zapomniałem! Chociaż moim zdaniem łatwiej jest zapamiętać listę nr 1. Z fundamentalnie ważnych rzeczy z listy nr 2 jeszcze raz wspomnę o wodzie.
Poćwiczmy!
Przykład 2. Napisz pełne równanie jonowe opisujące oddziaływanie wodorotlenku miedzi(II) i kwasu solnego.
Rozwiązanie. Zacznijmy oczywiście od równania molekularnego. Wodorotlenek miedzi(II) jest nierozpuszczalną zasadą. Wszystkie nierozpuszczalne zasady reagują z mocnymi kwasami, tworząc sól i wodę:
Cu(OH) 2 + 2HCl = CuCl 2 + 2H 2 O.
Zastanówmy się teraz, które substancje należy zapisać jako jony, a które jako cząsteczki. Powyższe listy nam w tym pomogą. Wodorotlenek miedzi(II) jest nierozpuszczalną zasadą (patrz tabela rozpuszczalności), słabym elektrolitem. Nierozpuszczalne zasady są zapisane w formie molekularnej. HCl jest mocnym kwasem; w roztworze prawie całkowicie dysocjuje na jony. CuCl2 jest rozpuszczalną solą. Zapisujemy to w formie jonowej. Woda - tylko w postaci cząsteczek! Otrzymujemy pełne równanie jonowe:
Cu(OH) 2 + 2H + + 2Cl - = Cu 2+ + 2Cl - + 2H 2O.
Przykład 3. Napisz pełne równanie jonowe reakcji dwutlenku węgla z wodnym roztworem NaOH.
Rozwiązanie. Dwutlenek węgla jest typowym tlenkiem kwasowym, NaOH jest zasadą. Kiedy tlenki kwasowe oddziałują z wodnymi roztworami zasad, powstaje sól i woda. Utwórzmy równanie molekularne reakcji (przy okazji nie zapomnij o współczynnikach):
CO2 + 2NaOH = Na2CO3 + H2O.
CO 2 - tlenek, związek gazowy; zachowując kształt molekularny. NaOH - mocna zasada (alkaliczna); Zapisujemy to w postaci jonów. Na2CO3 - sól rozpuszczalna; piszemy w postaci jonów. Woda jest słabym elektrolitem i praktycznie nie ulega dysocjacji; pozostawić w formie molekularnej. Otrzymujemy co następuje:
CO 2 + 2Na + + 2OH - = Na 2+ + CO 3 2- + H 2 O.
Przykład 4. Siarczek sodu w roztworze wodnym reaguje z chlorkiem cynku, tworząc osad. Napisz pełne równanie jonowe tej reakcji.
Rozwiązanie. Siarczek sodu i chlorek cynku są solami. Kiedy te sole oddziałują, wytrąca się osad siarczku cynku:
Na2S + ZnCl2 = ZnS↓ + 2NaCl.
Zaraz napiszę całe równanie jonowe, a Ty sam je przeanalizujesz:
2Na + + S 2- + Zn 2+ + 2Cl - = ZnS↓ + 2Na + + 2Cl - .
Oferuję Ci kilka zadań do samodzielnej pracy oraz krótki test.
Ćwiczenie 4. Napisz równania molekularne i pełne równania jonowe dla następujących reakcji:
- NaOH + HNO3 =
- H2SO4 + MgO =
- Ca(NO 3) 2 + Na 3 PO 4 =
- CoBr2 + Ca(OH)2 =
Ćwiczenie 5. Napisz pełne równania jonowe opisujące oddziaływanie: a) tlenku azotu (V) z wodnym roztworem wodorotlenku baru, b) roztworu wodorotlenku cezu z kwasem jodowodorowym, c) wodnych roztworów siarczanu miedzi i siarczku potasu, d) wodorotlenku wapnia i wodny roztwór azotanu żelaza (III).
Rozwiązywanie równań reakcji chemicznych sprawia trudności znacznej liczbie uczniów szkół średnich, głównie ze względu na dużą różnorodność występujących w nich pierwiastków i niejednoznaczność ich interakcji. Ponieważ jednak główna część zajęć z chemii ogólnej w szkole bada interakcję substancji w oparciu o równania ich reakcji, uczniowie muszą koniecznie uzupełnić luki w tym obszarze i nauczyć się rozwiązywać równania chemiczne, aby uniknąć problemów z tym przedmiotem w przyszłości.
Równanie reakcji chemicznej jest zapisem symbolicznym, który przedstawia oddziałujące pierwiastki chemiczne, ich stosunek ilościowy oraz substancje powstałe w wyniku interakcji. Równania te odzwierciedlają istotę oddziaływania substancji z punktu widzenia oddziaływania atomowo-molekularnego lub elektronicznego.
- Już na samym początku szkolnego kursu chemii uczy się ich rozwiązywania równań opartych na pojęciu wartościowości pierwiastków układu okresowego. Bazując na tym uproszczeniu, rozważmy rozwiązanie równania chemicznego na przykładzie utleniania aluminium tlenem. Aluminium reaguje z tlenem tworząc tlenek glinu. Mając określone dane początkowe, sporządzimy diagram równań.
Al + O2 → AlO
W tym przypadku spisaliśmy przybliżony schemat reakcji chemicznej, który tylko częściowo oddaje jej istotę. Substancje biorące udział w reakcji zapisano po lewej stronie diagramu, a wynik ich interakcji po prawej stronie. Ponadto tlen i inne typowe utleniacze są zwykle zapisywane po prawej stronie metali i innych środków redukujących po obu stronach równania. Strzałka pokazuje kierunek reakcji.
- Aby ten skompilowany schemat reakcji uzyskał pełną formę i był zgodny z prawem zachowania masy substancji, konieczne jest:
- Umieść wskaźniki po prawej stronie równania dla substancji powstałej w wyniku interakcji.
- Wyrównaj ilość pierwiastków biorących udział w reakcji z ilością powstałej substancji zgodnie z prawem zachowania masy substancji.
- Umieść wskaźniki po prawej stronie równania dla substancji powstałej w wyniku interakcji.
- Zacznijmy od zawieszenia indeksów dolnych we wzorze chemicznym gotowej substancji. Indeksy są ustalane zgodnie z wartościowością pierwiastków chemicznych. Wartościowość to zdolność atomów do tworzenia związków z innymi atomami w wyniku połączenia ich niesparowanych elektronów, gdy niektóre atomy oddają swoje elektrony, podczas gdy inne dodają je do siebie na zewnętrznym poziomie energii. Powszechnie przyjmuje się, że wartościowość pierwiastka chemicznego zależy od jego grupy (kolumny) w układzie okresowym. Jednak w praktyce oddziaływanie pierwiastków chemicznych jest znacznie bardziej złożone i zróżnicowane. Na przykład atom tlenu we wszystkich reakcjach ma wartościowość Ⅱ, mimo że znajduje się w szóstej grupie układu okresowego.
- Aby pomóc Ci poruszać się po tej różnorodności, oferujemy następujący mały asystent, który pomoże Ci określić wartościowość pierwiastka chemicznego. Wybierz element, który Cię interesuje, a zobaczysz możliwe wartości jego wartościowości. Rzadkie wartościowości wybranego pierwiastka podano w nawiasach.
- Wróćmy do naszego przykładu. Zapiszmy jego wartościowość po prawej stronie diagramu reakcji nad każdym elementem.
Dla aluminium Al wartościowość będzie równa Ⅲ, a dla cząsteczki tlenu O 2 wartościowość będzie równa Ⅱ. Znajdź najmniejszą wspólną wielokrotność tych liczb. Będzie równa sześć. Dzielimy najmniejszą wspólną wielokrotność przez wartościowość każdego elementu i otrzymujemy indeksy. W przypadku aluminium podziel sześć przez wartościowość, aby uzyskać wskaźnik 2, dla tlenu 6/2 = 3. Wzór chemiczny tlenku glinu otrzymany w wyniku reakcji będzie miał postać Al 2 O 3.
Al + O 2 → Al 2 O 3
- Po uzyskaniu prawidłowego wzoru gotowej substancji należy sprawdzić i w większości przypadków wyrównać prawą i lewą część diagramu zgodnie z prawem zachowania masy, ponieważ produkty reakcji powstają z tych samych atomów, które były pierwotnie częścią substancji wyjściowych biorących udział w reakcji.
- Prawo zachowania masy stwierdza, że liczba atomów, które weszły w reakcję, musi być równa liczbie atomów powstałych w wyniku interakcji. W naszym schemacie interakcja obejmuje jeden atom glinu i dwa atomy tlenu. W wyniku reakcji otrzymujemy dwa atomy glinu i trzy atomy tlenu. Oczywiście, aby zachować zasadę zachowania masy, należy wyrównać diagram za pomocą współczynników pierwiastków i materii.
- Wyrównanie przeprowadza się również poprzez znalezienie najmniejszej wspólnej wielokrotności, która znajduje się pomiędzy elementami o największych wskaźnikach. W naszym przykładzie będzie to tlen o indeksie po prawej stronie równym 3, a po lewej 2. Najmniejsza wspólna wielokrotność w tym przypadku również będzie równa 6. Teraz dzielimy najmniejszą wspólną wielokrotność przez wartość największego wskaźnika po lewej i prawej stronie równania i uzyskaj następujące wskaźniki dla tlenu.
Al + 3∙O 2 → 2∙Al 2 O 3
- Teraz pozostaje tylko wyrównać aluminium po prawej stronie. Aby to zrobić, umieść współczynnik 4 po lewej stronie.
4∙Al + 3∙O 2 = 2∙Al 2 O 3
- Po uporządkowaniu współczynników równanie reakcji chemicznej odpowiada prawu zachowania masy, a pomiędzy jego lewą i prawą stroną można postawić znak równości. Współczynniki umieszczone w równaniu wskazują liczbę cząsteczek substancji biorących udział w reakcji i powstałych w jej wyniku lub stosunek molowy tych substancji.
Instrukcje
Określ, które substancje oddziałują ze sobą podczas Twojej reakcji. Zapisz je po lewej stronie równania. Rozważmy na przykład reakcję chemiczną pomiędzy i siarką. Umieść odczynniki po lewej stronie: Al+H2SO4
Zapisz więc materiały wyjściowe po lewej stronie reakcji: CH4 + O2.
Odpowiednio po prawej stronie będą produkty reakcji: CO2 + H2O.
Wstępny zapis tej reakcji chemicznej będzie następujący: CH4 + O2 = CO2 + H2O.
Wyrównaj powyższą reakcję, czyli upewnij się, że spełniona jest podstawowa zasada: liczba atomów każdego pierwiastka po lewej i prawej stronie reakcji chemicznej musi być taka sama.
Widzisz, że liczba atomów węgla jest taka sama, ale liczba atomów tlenu i wodoru jest inna. Po lewej stronie znajdują się 4 atomy wodoru, a po prawej tylko 2. Dlatego przed wzorem na wodę należy umieścić współczynnik 2: CH4 + O2 = CO2 + 2H2O.
Atomy węgla i wodoru są wyrównane, teraz pozostaje zrobić to samo z tlenem. Po lewej stronie znajdują się 2 atomy tlenu, a po prawej - 4. Umieszczając przed cząsteczką tlenu współczynnik 2, otrzymujemy końcowy zapis reakcji utleniania metanu: CH4 + 2O2 = CO2 + 2H2O.
Równanie reakcji to konwencjonalny zapis procesu chemicznego, w którym niektóre substancje przekształcają się w inne ze zmianą właściwości. Do zapisu reakcji chemicznych wykorzystuje się wzory substancji oraz wiedzę o właściwościach chemicznych związków.

Instrukcje
Zapisz zgodnie z nimi poprawnie wzory. Przykładowo, umieść tlenek glinu Al₂O₃, indeks 3 z aluminium (odpowiadający jego stopniowi utlenienia w tym związku) w pobliżu tlenu, a indeks 2 (stan utlenienia tlenu) w pobliżu aluminium.
Jeśli stopień utlenienia wynosi +1 lub -1, wówczas wskaźnik nie jest podany. Na przykład musisz zapisać formułę. Azotan to kwasowa pozostałość kwasu azotowego (-NO₃, d.o. -1), amonu (-NH₄, d.o. +1). Zatem azotan amonu to NH₄NO₃. Czasami w nazwie związku podany jest stopień utlenienia. Tlenek siarki (VI) - SO₃, tlenek krzemu (II) SiO. Niektóre (gazy) są zapisywane z indeksem 2: Cl₂, J₂, F₂, O₂, H₂ itp.
Trzeba wiedzieć, które substancje reagują. Widoczne reakcje: wydzielanie się gazu, zmiana koloru i wytrącanie się. Bardzo często reakcje mijają bez widocznych zmian.
Przykład 1: reakcja neutralizacji
H₂SO₄ + 2 NaOH → Na₂SO₄ + 2 H₂O
Wodorotlenek sodu reaguje z kwasem siarkowym, tworząc rozpuszczalną sól: siarczan sodu i wodę. Jon sodu zostaje odszczepiony i łączy się z jonem kwasowym, zastępując wodór. Reakcja zachodzi bez zewnętrznych znaków.
Przykład 2: próba jodoformowa
С₂H₅OH + 4 J₂ + 6 NaOH → CHJ₃↓ + 5 NaJ + HCOONa + 5 H₂O
Reakcja przebiega w kilku etapach. Efektem końcowym jest wytrącanie się żółtych kryształów jodoformu (reakcja jakościowa).
Przykład 3:
Zn + K₂SO₄ ≠
Reakcja jest niemożliwa, ponieważ W szeregu naprężeń metali cynk następuje po potasie i nie może go wyprzeć ze związków.
Prawo zachowania stanów masowych: masa substancji wchodzących w reakcję jest równa masie powstałych substancji. Prawidłowe zarejestrowanie reakcji chemicznej to połowa sukcesu. Konieczne jest ustawienie współczynników. Rozpocznij wyrównywanie od tych związków, których wzory zawierają duże indeksy.
K₂Cr₂O₇ + 14 HCl → 2 CrCl₃ + 2 KCl + 3 Cl₂ + 7 H₂O
Zacznij ustalać współczynniki od dwuchromianu potasu, ponieważ jego wzór zawiera największy indeks (7).
Taka dokładność zapisu jest konieczna do obliczenia masy, objętości, stężenia, uwolnionej energii i innych wielkości. Bądź ostrożny. Zapamiętaj najpopularniejsze wzory i zasady, a także reszty kwasów.
Źródła:
- równanie chemiczne
